Amonij
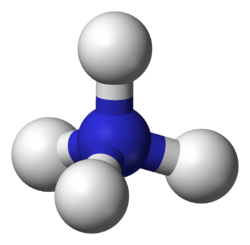
Amonij ion Šablon:Chem+ (po IUPAC-u također i azanij ion) jeste poliatomski kation koji sa anionima slično kao i sa ionima alkalnih metala gradi soli. On je konjugirana kiselina za bazični amonijak Šablon:Chem. Primjer amonijevih soli su amonij-nitrat Šablon:Chem i amonij-hlorid Šablon:Chem. Kod organskih amonijevih soli, atom dušika također ima četiri veze i jedan pozitivni formalni naboj. Međutim, najmanje jedan organski radikal je vezan na atom dušika, kao što je to naprimjer slučaj kod hidrohlorida.
Amonij ion nastaje protonizacijom amonijaka. Amonij ion je slaba Bronstedova kiselina, pa može otpustiti proton (reakcija je reverzibilna). Elektronski par na atomu dušika formira vezu sa protonom:
Osobine
Amonij ion je tetraedarskog oblika. Sa amonijakom stoji u disocijacijskoj ravnoteži. Pošto u ovoj ravnoteži učestvuje i oksonij ion, ona zavisi od pH vrijednosti okruženja. Udio amonijaka raste porastom pH vrijednosti i rastom temperature.
Amonijeva pKs vrijednost iznosi 9,2. Soli amonija (kao što je amonij-sulfat) u vodenim rastvorima reagiraju kao slabe kiseline i stoga grade slabo kisele rastvore.[1]
Atom dušika u amoniju može se relativno lahko oksidirati do molekulskog dušika. Tipičan primjer za to je termički raspad amonij-dihromata.[1]
U literaturi amonijeve soli ponekad se opisuju i kao pseudoalkalne soli, što je rezultat njihovih osobina koje nalikuju osobinama soli alkalnih metala. Ova analogija može se objasniti sličnostima obje vrste iona u aspektu ionskog radijusa i sličnog naboja. Alkalnim solima najviše su slične u pogledu njihove rastvorljivosti u vodi.[2]
Biološki značaj
Amonij ion je produkt metabolizma kod životinja. Kod sisara se uključuje u ciklus uree, gdje se pretvara u ureu, kao manje toksičnu formu.
Reference
- ↑ 1,0 1,1 M. Binnewies et al.: Allgemeine und Anorganische Chemie, 2. izd. Spektrum, 2010, Šablon:ISBN. str. 478f.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie, 101. izd. de Gruyter, Berlin 1995, Šablon:ISBN, str. 654.